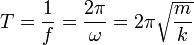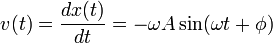TEMPERATURA
La temperatura es una magnitud referida a las nociones
comunes de caliente, tibio o frío que puede ser medida con un termómetro.
TERMOMETRIA
Se encarga de la medición de la temperatura de cuerpos o sistemas. Para este fin, se utiliza el termómetro, que es un instrumento que se basa en el cambio de alguna propiedad de la materia debido al efecto del calor; así se tiene el termómetro de mercurio y de alcohol.
Escalas termodinámicas:
Para definir una escala de temperaturas es necesario elegir una
propiedad termométrica que reúna las siguientes condiciones:
1.-La expresión matemática de la relación entre la propiedad y la
temperatura debe ser conocida.
2.-La propiedad termométrica debe ser lo bastante sensible a las
variaciones de temperatura como para poder detectar, con una precisión
aceptable, pequeños cambios térmicos.
3.-El rango de temperatura accesible debe ser suficientemente grande.
Existen
varias escalas termométricas para medir temperaturas, relativas y absolutas como :
*Escala Celsius: Esta escala es de uso popular en los países que adhieren al
Sistema Internacional de Unidades, por lo que es la más utilizada mundialmente.
Fija el valor de 0° grados para la fusión del agua y 100° para su ebullición.
*Escala Fahrenheit: En los países anglosajones se pueden encontrar aún termómetros
graduados en grado Fahrenheit (°F). Esta escala difiere de la Celsius tanto en los valores asignados a los
puntos fijos, como en el tamaño de los grados. En la escala Fahrenheit los
puntos fijos son los de ebullición y fusión de una disolución de cloruro
amónico en agua. Así al primer punto fijo se le atribuye el valor 32° y al
segundo el valor 212°.
*Escala Kelvin o absoluta: En la escala absoluta, al 0 °C le hace corresponder 273,15 K,
mientras que los 100 °C se corresponden con 373,15 K. Se ve inmediatamente que
0 K está a una temperatura que un termómetro centígrado señalará como -273,15
°C. Dicha temperatura se denomina "cero absoluto".
TERMÓMETROS
Son instrumentos destinados a medir temperaturas
con escalas en grados centígrados o Fahrenheit.El mas empleado es aquel con graduaciones de 1 º C (pudiendo apreciarse hasta
0,5 º C) que va desde -10 º C hasta 200 º C.
Usos:
Usos:
-Se les
emplea para medir temperaturas en operaciones de destilación, para
determinación de puntos de fusión, etc. Deberá estar limpio para introducirlo en el
líquido o la solución cuya temperatura se quiere encontrar.
-Para líquidos que estén en ebullición, el termómetro deberá introducirse
sin que este en contacto con la paredes del recipiente y a una profundidad que
sea la mitad de la altura de la solución.
DILATACIÓN
Llamamos dilatación al cambio de dimensiones
que experimentan los sólidos, líquidos y gases cuando se varía la temperatura,
permaneciendo la presión constante.La mayoría de los cuerpos se dilatan cuando
se calientan y se contraen cuando se enfrían.Al calentar un cuerpo, las moléculas
se mueven más rápido, chocan fuertemente y se separan entre ellas.
Ejemplo:
Para
explicar este comportamiento, podríamos imaginar una pista de baile, en ella
pueden caber muchas personas si se encuentran muy juntas y no se mueven, pero
si ahora bailan despacio, entonces, ocupan más campo y chocan entre ellas; si
bailan más rápidamente ocuparán aún mayor espacio y los choques serán más
frecuentes.
La dilatación se da 3 formas :
-Dilatación lineal:
Es el incremento de longitud de un material al elevar la temperatura.El efecto más frecuente producido por cambios de temperatura es un
cambio en el tamaño. Con pocas excepciones, todas
las sustancias incrementan su tamaño cuando se eleva la temperatura. Los átomos en un sólido se mantienen juntos en
un arreglo regular debido a la acción de fuerzas eléctricas. A cualquier temperatura , los átomos vibran
con cierta frecuencia y amplitud.
Donde:
L0 = longitud inicial.
L = longitud final.
ΔL = dilatación (DL > 0) ó contracción (DL < 0)
Δθ = θ0 – θ (variación de la temperatura)
-Dilatación volumetrica:
Es aquella en que predomina la variación en
tres dimensiones, o sea, la variación del volumen del cuerpo.Para estudiar este tipo de dilatación, podemos imaginar un cubo metálico de volumen inicial V0 y la temperatura inicial θ0. Si lo calentamos hasta la temperatura final, su volumen pasará a tener un valor final igual a V.
-Dilatación superficial:
Es aquella en que predomina la variación en dos
dimensiones, o sea, la variación del área del cuerpo. Para estudiar este tipo
de dilatación, podemos imaginar una placa metálica de área inicial S0 y temperatura inicial θ0. Si
la calentáramos hasta la temperatura final θ, su área pasará
a tener un valor final igual a S.
Aplicación en química:
La dilatación de los sólidos es mayor que la se los líquidos,
y la de los gases, mayor que la de los sólidos, por lo tanto, los gases
tienen una mayor dilatación. En los gases y líquidos las partículas chocan
unas contra otras en forma continua, pero si se calientan, chocarán
violentamente rebotando a mayores distancias y provocarán la dilatación. En los
sólidos las partículas vibran alrededor de posiciones fijas; sin embargo al
calentarse aumentan su movimiento y se alejan de sus centros de vibración dando
como resultado la dilatación. Por el contrario, al bajar la temperatura las
partículas vibran menos y el sólido se contrae.
CALOR
Es la Energía Térmica que se transfiere de un objeto a otro cuando entran en contacto mutuo, debido a una diferencia de temperaturas entre ellos.La dirección de la transferencia de la Energía Térmica es siempre desde la sustancia de mayor temperatura hacia la de menor temperatura A -> B
Es la energía interna total de un cuerpo, es decir, la suma de las energías moleculares: cinética y potencial.
CALORIMETRIA
Es la medida de la cantidad de calor que cede o absorbe un cuerpo en el curso de un proceso físico o químico.
-Cuando fluye calor entre dos objetos o sustancias que se encuentran unidas; se dice que están en CONTACTO TÉRMICO.
-Cuando dos objetos se encuentran en contacto térmico, la temperatura del más caliente disminuye y la del más frío aumenta, hasta llegar ambos a la misma temperatura, es decir, quedan en EQUILIBRIO TÉRMICO.
Expresado en forma de ecuación, queda:
Q = calor transferido
∆E = cambio de energía interna
∆E = cambio de energía interna
Son los procesos a través de los cuales un estado de la materia cambia a otro manteniendo una semejanza en su composición. A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia:
Cambios de fase de una sustancia:
-Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso isotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante.
-Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico.
-Vaporización y ebullición: Son los procesos físicos en los que un líquido pasa a estado gaseoso.
-Condensación: Se denomina condensación al cambio de estado de la materia que se encuentra en forma gaseosa a forma líquida.
-Sublimación: es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido.
Calor latente:
El calor latente es la energía requerida por una cantidad de sustancia para cambiar de fase, de sólido a líquido (calor de fusión) o de líquido a gaseoso (calor de vaporización).Se debe tener en cuenta que esta energía en forma de calor se invierte para el cambio de fase y no para un aumento de la temperatura; por tanto al cambiar de gaseoso a líquido y de líquido a sólido se libera la misma cantidad de energía.
Calor sensible:
Calor sensible es aquel que recibe un cuerpo o un objeto y hace que aumente su temperatura sin afectar su estructura molecular y por lo tanto su estado. En general, se ha observado experimentalmente que la cantidad de calor necesaria para calentar o enfriar un cuerpo es directamente proporcional a la masa del cuerpo y a la diferencia de temperaturas. La constante de proporcionalidad recibe el nombre de calor específico.
Unidades de medica de calor:
Sin embargo, en la práctica se manejan otras unidades más adecuadas:
-Caloria (c)
-Caloria (c)
Es la cantidad de calor que se requiere para elevar la temperatura de 1 gramo de
agua en 1°C. La relación entre calorías y joules es de:
elevar en 1°C la temperatura de 1 Kg de agua).
Aplicación en química:
Podemos medir el calor en una reacción química, el calor que se intercambia entre dos o más elementos, el calor que se pierde en un cambio de estado de la materia, por ejemplo de sólido a líquido, el calor específico de una sustancia, o de un elemento químico y otros tipos de experimentos que nos planeemos hacer.
TRANSMISIÓN DE CALOR
Se ha descrito a la transferencia de calor
como el estudio de las velocidades a las cuales el calor se intercambia entre
fuentes de calor y recibidores, tratados usualmente de manera independiente.
Los procesos de transferencia de calor se relacionan con las razones de
intercambio térmico, tales como las que ocurren en los equipos de transferencia
de calor, tanto en la ingeniería mecánica como en los procesos químicos.
Formas de transmicion de calor
Conducción
Si existe un gradiente de temperatura en una
sustancia el calor puede fluir sin que tenga lugar un movimiento observable de
la materia.
Ejemplo: El ejemplo más común de conducción
es el flujo de calor en sólidos opacos, tales como la pared de ladrillo de un
horno o la pared metálica de un tubo.
-La
conductividad térmica: Es una característica de todo material que representa la resistencia
que este ofrece al flujo de calor. Se denota con la letra k.
-Flujo
de Calor a través de una Pared De
la ecuación dQ =k dA (dt/dx) se obtuvo la ecuación general cuando el flujo de calor
y las temperaturas de entrada y salida de las dos caras opuestas del cubo
elemental parcialmente aislado dx dy dz, fueron constantes. Integrando la
ecuación anterior cuando todas las variables excepto la Q son independientes,
la ecuación del estado estable es:
Convección
Cuando
una corriente o una partícula macroscópica (que se puede ver a simple vista) de
materia cruza una superficie específica, tal como el límite de un volumen específico,
lleva consigo una determinada cantidad de energía asociada “entalpía”. Este flujo
de entalpía recibe el nombre de flujo convectivo de calor o simplemente
convección.
Ejemplo:
La transferencia de entalpía por los remolinos de flujo turbulento y por la corriente
de aire caliente que circula a través y hacia fuera de un radiador ordinario.
Las
fuerzas utilizadas para crear las corrientes de conversión en los fluidos son
dedos tipos:
-Convección
natural
Ocurre
si las corrientes son la consecuencia de las fuerzas de flotación generadas por
la diferencia de densidad, que o su vez se generan por gradientes de
temperatura en la masa de fluido. El flujo de aire a través de un radiador
caliente es un ejemplo de convección natural, otro ejemplo es cuando se caliente
agua en una olla sin agitación se puede observar las líneas de convección que
se forman.
-Convección forzada
Ocurre cuando las corrientes se ponen en movimiento por acción
de algún dispositivo mecánico, tal como una bomba o un agitador. El flujo de
calor hacia un fluido que se bombea a través de una tubería caliente es un ejemplo
de convección forzada.
Los
dos tipos de Fuerzas pueden ser activas simultáneamente en el mismo fluido, teniendo
lugar conjuntamente convección natural y forzada
Radiación
Radiación
es la palabra que se utiliza para designar la transmisión de energía a través
del espacio. Si la radiación pasa a través de un espacio vacío, no se
transforma en calor ni en otra forma de energía. Sin embargo, si en su camino
encuentra material, la radiación se transmitirá, reflejará o absorberá.
Ejemplo:
La transmisión de calor en hornos y otros aparatos que operan con gases a temperaturas
elevadas. Otro claro ejemplo es la energía solar o radiación solar.
Aplicación en química:
Intercambiadores de calor de casco y placas
Los intercambiadores de calor de casco y placas (PSHE) Vahterus combinan los beneficios de los intercambiadores de calor de casco y tubo y los intercambiadores de placas y juntas. Los PSHE pueden ser referenciados como intercambiadores de calor de placas completamente soldadas pero sin juntas, o bien como una alternativa genérica a los intercambiadores de casco y tubo utilizando sólo el 25% del espacio de éstos.
Con un área de transferencia máxima de 2000 m2 por intercambiador y el potencial de ser utilizados con presiones de diseño de hasta 150 bar, los PSHE de Vahterus son capaces de cumplir con requerimientos de transferencia de calor en las industrias químicas y de procesos. La operación de PSHE basados en su construcción completamente soldadad es lograda sobre una amplia temperatura (164 a 899 °C) y una capacidad de hasta 20000 KW por intercambiador.
-Transmisión de
calor por conducción
La conducción es la forma en que tiene lugar la
transferencia de energía a escala molecular. Cuando las moléculas absorben energía térmica vibran sin desplazarse,
aumentando la amplitud de la vibración conforme aumenta el nivel de energía.
Esta vibración se transmite de unas moléculas a otras sin que tenga lugar movimiento
alguno de traslación.
-Transmisión de calor por convección
Cuando un fluido circula alrededor de un sólido,
por ejemplo por el interior de una tubería, existiendo una diferencia de
temperatura entre ambos tiene lugar un intercambio de calor entre ellos.
La termodinámica es la rama de la física que describe los estados de equilibrio a nivel microscópico .Los estados de equilibrio son estudiados y definidos por medio de magnitudes extensivas tales como la energía interna, la entropía, el volumen o la composición molar del sistema, o por medio de magnitudes no-extensivas derivadas de las anteriores como la temperatura,presión y el potencial químico; otras magnitudes tales como la imanación, la fuerza electromotriz y las asociadas con la mecánica de los medios continuos en general también pueden ser tratadas por medio de la termodinámica.
LEYES DE LA TERMODINÁMICA
-Principio cero de la termodinámica:
Este principio o ley cero, establece que existe una
determinada propiedad denominada temperatura empírica θ, que es común para
todos los estados de equilibrio termodinámico que se
encuentren en equilibrio mutuo con uno dado.
En
palabras llanas: «Si pones en contacto un objeto frío con otro caliente, ambos
evolucionan hasta que sus temperaturas se igualan».
-Primera ley de la termodinámica:
También conocida como principio de conservación de la
energía para la termodinámica , establece que si se realiza
trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará.
En palabras llanas: "La energía ni se crea ni se destruye:
sólo se transforma".
La ecuación general de la conservación de la energía es la
siguiente:
Que aplicada a la termodinámica teniendo en cuenta el criterio de signos termodinámico, queda de
la forma:
La
ecuación general de la conservación de la energía es la siguiente:
Donde
U es la energía interna del sistema (aislado), Q es la cantidad de calor
aportado al sistema y W es el trabajo realizado por el sistema.
-Segunda ley de la termodinámica:
Esta ley marca la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto,
la imposibilidad de que ocurran en el sentido contrario (por ejemplo, que una
mancha de tinta dispersada en el agua pueda volver a concentrarse en un pequeño
volumen). También establece, en algunos casos, la imposibilidad de convertir completamente
toda la energía de un tipo en otro sin pérdidas. De esta forma, la segunda ley
impone restricciones para las transferencias de energía que hipotéticamente
pudieran llevarse a cabo teniendo en cuenta sólo el primer principio.
APLICACIONES EN QUÍMICA:
El estudio de la viabilidad de reacciones químicas:
La evolución de los sistemas termodinámicos se desarrolla a través de las interacciones entre las partículas que los componen y entre ellas y las exteriores. Normalmente la interacción no es muy energética y los procesos de relajación a que da lugar se dice que son de tipo térmico (pudiéndose incluir aquí los cambios de fase), permaneciendo invariable la cantidad de cada especie química. Pero existen otras interacciones más energéticas que llegan a romper los enlaces químicos (reacción química), desapareciendo unos y apareciendo otros. Todavía existen reacciones más energéticas, que llegan a romper los enlaces nucleares (reacciones nucleares). Notese que, cambiando la definición de especie química, también se pueden incluir aquí los cambios de fase, transformaciones alotrópicas, isomerización, ionización, disociación, cambios de nivel energético, etc. Los procesos reactivos son de particular importancia en combustión (motores térmicos, calderas, fuegos), en síntesis de materiales artificiales (metales, plásticos, cerámica y vidrio, tejidos artificiales, etc), y en general en toda la industria de productos químicos.
MOVIMIENTO ARMÓNICO SIMPLE
El movimiento armónico simple es un movimiento periódico de vaivén, en el que un cuerpo oscila a un lado y a otro de su posición de equilibrio, en una dirección determinada, y en intervalos iguales de tiempo.
El movimiento armónico simple(se abrevia m.a.s.) es un movimiento periódico que queda descrito en función del tiempo por una función armónica (seno o coseno). Si la descripción de un movimiento requiriese más de una función armónica, en general sería un movimiento armónico, pero no un m.a.s..
En el caso de que la trayectoria sea rectilínea, la partícula que realiza un m.a.s. oscila alejándose y acercándose de un punto, situado en el centro de su trayectoria, de tal manera que su posición en función del tiempo con respecto a ese punto es una sinusoide. En este movimiento, la fuerza que actúa sobre la partícula es proporcional a su desplazamiento respecto a dicho punto y dirigida hacia éste.
Cinemática del movimiento armónico simple
Ecuación del movimiento
Elongación
En un movimiento armónico simple la magnitud de la fuerza ejercida sobre la partícula es directamente proporcional a su elongación, esto es la distancia 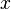 a la que se encuentra ésta respecto a su posición de equilibrio. En un desplazamiento a lo largo del eje Ox, tomando el origen O en la posición de equilibrio, esta fuerza es tal que
a la que se encuentra ésta respecto a su posición de equilibrio. En un desplazamiento a lo largo del eje Ox, tomando el origen O en la posición de equilibrio, esta fuerza es tal que  donde
donde  es una constante positiva y
es una constante positiva y 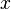 es la elongación. El signo negativo indica que en todo momento la fuerza que actúa sobre la partícula está dirigida hacía la posición de equilibrio; esto es, en sentido contrario a su elongación (la “atrae” hacia la posición de equilibrio).
es la elongación. El signo negativo indica que en todo momento la fuerza que actúa sobre la partícula está dirigida hacía la posición de equilibrio; esto es, en sentido contrario a su elongación (la “atrae” hacia la posición de equilibrio).
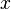 a la que se encuentra ésta respecto a su posición de equilibrio. En un desplazamiento a lo largo del eje Ox, tomando el origen O en la posición de equilibrio, esta fuerza es tal que
a la que se encuentra ésta respecto a su posición de equilibrio. En un desplazamiento a lo largo del eje Ox, tomando el origen O en la posición de equilibrio, esta fuerza es tal que  donde
donde  es una constante positiva y
es una constante positiva y 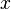 es la elongación. El signo negativo indica que en todo momento la fuerza que actúa sobre la partícula está dirigida hacía la posición de equilibrio; esto es, en sentido contrario a su elongación (la “atrae” hacia la posición de equilibrio).
es la elongación. El signo negativo indica que en todo momento la fuerza que actúa sobre la partícula está dirigida hacía la posición de equilibrio; esto es, en sentido contrario a su elongación (la “atrae” hacia la posición de equilibrio).
Aplicando la segunda ley de Newton, el movimiento armónico simple se define entonces en una dimensión mediante la ecuación diferencial
Siendo  la masa del cuerpo en desplazamiento. Escribiendo
la masa del cuerpo en desplazamiento. Escribiendo 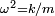 se obtiene la siguiente ecuación donde ω es la frecuencia angular del movimiento:
se obtiene la siguiente ecuación donde ω es la frecuencia angular del movimiento:
 la masa del cuerpo en desplazamiento. Escribiendo
la masa del cuerpo en desplazamiento. Escribiendo 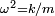 se obtiene la siguiente ecuación donde ω es la frecuencia angular del movimiento:
se obtiene la siguiente ecuación donde ω es la frecuencia angular del movimiento:
La solución de la ecuación diferencial puede escribirse en la forma
donde:
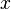 es la elongación de la partícula.
es la elongación de la partícula.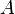 es la amplitud del movimiento (elongación máxima).
es la amplitud del movimiento (elongación máxima). es la frecuencia angular
es la frecuencia angular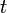 es el tiempo.
es el tiempo. es la fase inicial e indica el estado de oscilación o vibración (o fase) en el instante t = 0 de la partícula que oscila.
es la fase inicial e indica el estado de oscilación o vibración (o fase) en el instante t = 0 de la partícula que oscila.
Además, la frecuencia de oscilación puede escribirse como
, y por lo tanto el periodo como
La velocidad y aceleración de la partícula pueden obtenerse derivando respecto del tiempo la expresión
 .
.Velocidad
La velocidad se obtiene derivando la ecuación de la posición obtenida en el apartado anterior respecto al tiempo:
Aceleración
La aceleración es la variación de la velocidad del movimiento respecto al tiempo y se obtiene por lo tanto derivando la ecuación de la velocidad respecto al tiempo:
Amplitud y fase inicial
La amplitud A y la fase inicial  se pueden calcular a a partir de las condiciones iniciales del movimiento, esto es de los valores de la elongación x0 y de la velocidad v0 iniciales.
se pueden calcular a a partir de las condiciones iniciales del movimiento, esto es de los valores de la elongación x0 y de la velocidad v0 iniciales.
 se pueden calcular a a partir de las condiciones iniciales del movimiento, esto es de los valores de la elongación x0 y de la velocidad v0 iniciales.
se pueden calcular a a partir de las condiciones iniciales del movimiento, esto es de los valores de la elongación x0 y de la velocidad v0 iniciales.
Sumando miembro a miembro las dos ecuaciones obtenemos:
Dividiendo miembro a miembro las dos ecuaciones obtenemos:
APLICACIONES EN QUÍMICA:
La espectroscopia ultravioleta-visible o espectrofotometría ultravioleta-visible (UV/VIS) es una espectroscopia de emisión de fotones y una espectrofotometría. Utiliza radiación electromagnética (luz) de las regiones visible, ultravioleta cercana (UV) e infrarroja cercana (NIR) del espectro electromagnético, es decir, una longitud de onda entre 380nm y 780nm. La radiación absorbida por las moléculas desde esta región del espectro provoca transiciones electrónicas que pueden ser cuantificadas.
La espectroscopia UV-visible se utiliza para identificar algunos grupos funcionales de moléculas, y además, para determinar el contenido y fuerza de una sustancia.
Se utiliza de manera general en la determinación cuantitativa de los componentes de soluciones de iones de metales de transición y compuestos orgánicos altamente conjugados.
Se utiliza extensivamente en laboratorios de química y bioquímica para determinar pequeñas cantidades de cierta sustancia, como las trazas de metales en aleaciones o la concentración de cierto medicamento que puede llegar a ciertas partes del cuerpo.
La espectroscopia UV-visible se utiliza para identificar algunos grupos funcionales de moléculas, y además, para determinar el contenido y fuerza de una sustancia.
Se utiliza de manera general en la determinación cuantitativa de los componentes de soluciones de iones de metales de transición y compuestos orgánicos altamente conjugados.
Se utiliza extensivamente en laboratorios de química y bioquímica para determinar pequeñas cantidades de cierta sustancia, como las trazas de metales en aleaciones o la concentración de cierto medicamento que puede llegar a ciertas partes del cuerpo.
MOVIMIENTO ONDULATORIO
El movimiento ondulatorio es la propagación de una onda por un medio material o en el vacío. Sin que exista la transferencia de materia ya que sea por ondas mecánicas o electromagnéticas.
Una onda es una perturbación de alguna propiedad de un medio (densidad, presión, campo eléctrico , campo magnético,...).
La onda transporta energía.Y así todo tipo de onda se adquiere mas fácil ya sea haciendo una ecuación o sustituyendo la respuesta mas rápidamente.
TIPOS DE ONDAS
Podemos establecer criterios de clasificación de las ondas.
Algunos serían:
Según el medio por el que se propaguen:
Ondas mecánicas. Son las que requieren un medio material
para propagarse.
Ejemplo, el sonido
La onda de sonido ordinario es una forma de transmisión
de energía, perturbaciones en el aire entre fuente vibrante que es la que
produce el sonido y un receptor tal como el oído. El sonido también puede transmitirse
en los líquidos y en los sólidos. Las ondas en una cuerda, en un resorte y las
ondas de agua son otros ejemplos de ondas que necesitan de un medio elástico
para propagarse. A este tipo de ondas se los denomina “ondas mecánicas”.
Ondas electromagnéticas. Son las que no requieren un
medio material. Ejemplo, la luz. Existe otro tipo de ondas relacionada con la
luz, transmisión de radio y radiación de calor, esto es las ondas electromagnéticas
que no necesitan de un medio para propagarse.
Según el número de dimensiones que involucran:
Unidimensionales.
Ejemplo, la propagación del movimiento en una cuerda
Dimensionales.
Ejemplo, olas en la superficie de un líquido.
Tridimensionales.
Ejemplo, el sonido normal. Según la
relación entre la vibración y la dirección de propagación
Transversales. Son aquellas ondas en las cuales la oscilación
es perpendicular a la dirección de propagación de la onda. Por ejemplo en una
cuerda normal y tensa la onda se propaga de izquierda a derecha (en cierto caso
particular) pero, en cambio, la oscilación de un punto concreto de la cuerda se
produce de arriba a abajo, es decir, perpendicularmente a la propagación.
Longitudinales. En este tipo la propagación es paralela a
la oscilación. Como ejemplo, si apretamos un resorte las espiras oscilan de
izquierda a derecha y de derecha a izquierda, paralelas en cualquier caso a la dirección
de propagación.
FORMULAS:
Pulsación: w = 2pf (rad/seg)
Periodo: T = 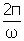 (seg)
(seg)
Frecuencia: f = 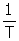 (Hz)
(Hz)
Velocidad de las ondas transversales en una cuerda: 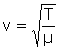
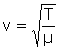
K =  (m-1)
(m-1)
m: masa por unidad de longitud
velocidad de propagación: v = l f (m/s)
Ecuación del movimiento ondulatorio armónico o función de onda:
y (t, x) = A sen 
Expresión de la función de onda: A sen (wt – kx)
Ecuación de la aceleración: a (t) = - Aw2 cos (wt + j0) ó a = -w2· x (t)
Fase del movimiento: wt + j0
En la ecuación de la elongación:
- Si el signo de kx = al signo de wt la dirección es de derecha a izquierda
- Si el signo de kx ¹ al signo de wt la dirección es de izquierda a derecha
APLICACIONES EN QUÍMICA:
Se
puede aplicar en los elementos químicos como el argón (gases nobles) , en
una temperatura constante , para poder ver a qué velocidad se propagan. Se
utiliza con la intención de saber de qué tipo de elemento químico se está
tratando.
ACÚSTICA
La acústica es una rama de la física ínterdisciplinaria que estudia el sonido, infrasonido y ultrasonido, es decir ondas mecánicas que se propagan a través de la materia (tanto sólida como líquida o gaseosa) (no pueden propagarse en el vacío) por medio de modelos físicos y matemáticos.
Las secciones dónde se estudia la acústica son:
-Sonido:
El sonido es una sensación, en el órgano del oído, producida por el movimiento ondulatorio en un medio elástico (normalmente el aire), debido a rapidísimos cambios de presión, generados por el movimiento vibratorio de un cuerpo sonoro.
El sonido es una sensación, en el órgano del oído, producida por el movimiento ondulatorio en un medio elástico (normalmente el aire), debido a rapidísimos cambios de presión, generados por el movimiento vibratorio de un cuerpo sonoro.
-Onda sonora:
Las variaciones de presión, humedad o temperatura del medio, producen el desplazamiento de las moléculas que lo forman. Cada molécula transmite la vibración a la de su vecina, provocando un movimiento ondulatorio en cadena.
Las variaciones de presión, humedad o temperatura del medio, producen el desplazamiento de las moléculas que lo forman. Cada molécula transmite la vibración a la de su vecina, provocando un movimiento ondulatorio en cadena.
-Sonoridad:
La sonoridad es una medida subjetiva de la intensidad con la que un sonido es percibido por el oído humano. Es decir, la sonoridad es el atributo que nos permite ordenar sonidos en una escala del más fuerte al más débil.
La sonoridad es una medida subjetiva de la intensidad con la que un sonido es percibido por el oído humano. Es decir, la sonoridad es el atributo que nos permite ordenar sonidos en una escala del más fuerte al más débil.
-Propagación del sonido:
a)Reflexion:Una onda cuando topa con un obstáculo que no puede traspasar se refleja (vuelve al medio del cual proviene).Una onda se refleja (rebota al medio del cual proviene) cuando topa con un obstáculo que no puede traspasar ni rodear.El tamaño del obstáculo y la longitud de onda determinan si una onda rodea el obstáculo o se refleja en la dirección de la que provenía.Si el obstáculo es pequeño en relación con la longitud de onda, el sonido lo rodeara (difracción), en cambio, si sucede lo contrario, el sonido se refleja (reflexión).
-Velocidad del sonido:
La velocidad del sonido es la velocidad de propagación de las ondas mecánicas longitudinales, producidas por variaciones de presión del medio. Estas variaciones de presión generan en el cerebro la sensación del sonido.
La velocidad del sonido es la velocidad de propagación de las ondas mecánicas longitudinales, producidas por variaciones de presión del medio. Estas variaciones de presión generan en el cerebro la sensación del sonido.
-Efecto doppler:
El efecto Doppler, llamado así por Christian Andreas Doppler, consiste en la variación de la longitud de onda de cualquier tipo de onda emitida o recibida por un objeto en movimiento.
El efecto Doppler, llamado así por Christian Andreas Doppler, consiste en la variación de la longitud de onda de cualquier tipo de onda emitida o recibida por un objeto en movimiento.
Aplicaciones en Química:
La
resonancia magnética nuclear utiliza radiofrecuencias a
los átomos alineados de una muestra orgánica, y permite estudiar la
composición química o estructural de la muestra, dependiendo del
estudio. Esta resonancia también se utiliza en la investigación de
ordenadores cuánticos o supercomputadoras. Sus aplicaciones mas
comunes están ligadas a la
medicina, bioquímica química orgánica, entre otras. El MRI
(magnética resonante Imaging) es un aparato comúnmente utilizado en hospitales
que obtiene imágenes por resonancia magnética; se usa en pacientes con
problemas neurológicos para detectar objetos extraños en el cuerpo
de un paciente, si existe un tumor, o hasta para detectar cáncer.
ÓPTICA
Establecimiento en el que se venden instrumentos para corregir o mejorar la visión.Parte de la física que estudia la luz y los fenómenos que tienen relación con ella.
Cuando una onda alcanza la superficie de separación
de dos medios de distinta naturaleza se producen, en general, dos nuevas ondas,
una que retrocede hacia el medio de partida y otra que atraviesa la superficie
límite y se propaga en el segundo medio.
La reflexión de la luz
Al igual que la reflexión de las ondas sonoras, la reflexión luminosa es
un fenómeno en virtud del cual la luz al incidir sobre la superficie de los
cuerpos cambia de dirección, invirtiéndose el sentido de su propagación. En
cierto modo se podría comparar con el rebote que sufre una bola de billar
cuando es lanzada contra una de las bandas de la mesa.
La refracción de la luz
Se denomina refracción luminosa al cambio que experimenta la dirección
de propagación de la luz cuando atraviesa oblicuamente la superficie de
separación de dos medios transparentes de distinta naturaleza.El
fenómeno de la refracción va, en general, acompañado de una reflexión, más o
menos débil, producida en la superficie que limita los dos medios
transparentes. El haz, al llegar a esa superficie límite, en parte se refleja y
en parte se refracta, lo cual implica que los haces reflejado y refractado
tendrán menos intensidad luminosa que el rayo incidente.
Aplicaciones en Química:
La propiedad refractiva de un material es la propiedad más importante de cualquier sistema óptico que usa refracción. Es un índice inverso que indica el grosor de los lentes según un poder dado, y el poder dispersivo de los prismas. También es usado en la química para determinar la pureza de los reactivos químicos y para la renderización de materiales refractantes en los gráficos 3D por computadora.
ÓPTICA - ESPEJOS
ÓPTICA - ESPEJOS
Son superficies reflectantes, pueden ser planos o curvos, los curvos pueden ser casquetes de esfera, paraboloides u otros sólidos de revolución, los mas utilizados son los casquetes de esfera.
Las caras con sombras son las superficies no brillantes, la cara opuesta es el espejo propiamente dicha.
TIPOS DE ESPEJOS
-Los espejos planos los utilizamos con mucha frecuencia. Si eres buen observador te habrás fijado en que la imagen producida por un espejo plano es virtual, ya que no la podemos proyectar sobre una pantalla, tiene el mismo tamaño que el objeto y se encuentra a la misma distancia del espejo que el objeto reflejado.
-Los espejos esfericos: Por definición, espejo es el nombre que recibe toda superficie o lamina de cristal azogado por la parte posterior, o de metal bruñido, para que se reflejen en ella los objetos. Por extensión se denomina “espejo” a toda superficie que produce reflexión de los objetos, por ej. : la superficie del agua.
ÓPTICA - LENTES
Las lentes con curvatura tienen pequeñas distancias focales.
En la curvatura permite curvar los rayos de luz que llegan al centro óptico ampliando el ángulo de observación original.Este ángulo al estar los objetos distantes se hace bastante pequeño y por ello los objetos se ven pequeñas las líneas.
Todo objeto tiene altura, los rayos que se forman al observar su base y su cúspide forman su ángulo.
TIPOS DE LENTES:
-Las lentes convergentes son más gruesas por el centro que por el borde, y concentran (hacen converger) en un punto los rayos de luz que las atraviesan. A este punto se le llama foco (F) y la separación entre él y la lente se conoce como distancia focal (f).
-Las lentes divergentes son más gruesas por los bordes que por el centro, hacen divergen (separan) los rayos de luz que pasan por ellas.
APLICACIONES EN QUÍMICA :
Cromatografía líquida de alta presión :
Las lámparas de deuterio Heraeus se utilizan como fuentes de luz en la cromatografía líquida de alta presión (HPLC).
HPLC es una técnica de análisis moderna que se utiliza hoy para comprobar la pureza de las drogas farmacéuticas y la contaminación en los productos alimenticios. Las lámparas de deuterio Heraeus proporcionan las fuentes de luz para estos análisis de alta sensibilidad y ayudan a determinar rastros de contaminación no deseada, por ejemplo, la melamina en leche en polvo para bebés. Generan un espectro continuo con longitudes de onda que alcanzan desde los rayos UV hasta lo visible, lo que hace de ellas una fuente de luz idónea para mediciones de alta precisión de absorción en el laboratorio.
Para cumplir con los límites de detección más bajos y mayor resolución de los instrumentos de análisis modernos, la última generación de lámparas de deuterio Heraeus alcanza valores de ruido que son de 2 a 3 veces inferiores en comparación con las lámparas de deuterio convencionales, con aprox. 30% menos energía radiada. Esto las hace ideales para su uso en detectores UHPLC (cromatografía de líquidos de ultra alto rendimiento) que se utilizan, por ejemplo, en las pruebas de drogas de exámen médico sanguíneo.
HPLC es una técnica de separación en la que se introduce una mezcla de muestra en una columna. Los diferentes compuestos de la mezcla pasan a través de la columna a diferentes velocidades debido a las diferencias en su comportamiento de partición entre la fase móvil y la fase estacionaria. Al final de la columna se separa entonces la mezcla en sus componentes individuales y pueden ser detectados mediante un detector de UV-Vis para medir la absorción de las sustancias en una longitud de onda determinada. El valor de absorción es proporcional a la concentración del compuesto (Ley Beer-Lambert).